工作动态
近日,国际学术期刊《PLOS Pathogens》在线发表了中国科学院武汉病毒研究所罗敏华团队的最新研究成果,论文题为“Human cytomegalovirus pUL97 upregulates SOCS3 expression via transcription factor RFX7 in neural progenitor cells”(《人巨细胞病毒的pUL97通过调控转录因子RFX7而上调神经干细胞中SOCS3的分子机制》)。该工作揭示了人巨细胞病毒(Human Cytomegalovirus,HCMV)感染导致胎脑损伤的一种新机制。先天性HCMV感染是引起新生儿中枢神经系统发育损伤最常见的感染性病因。先天性HCMV感染中最主要的靶细胞是位于脑室区和脑室下区的神经前体细胞(neural progenitor cell,NPC)。
NPCs在神经发生过程中首先产生神经元,随后在胶质细胞发生过程中产生胶质细胞;NPCs 的分化伴随神经元从室管膜下区向大脑皮层迁移形成 I~VI 层脑皮质结构。这个过程受到细胞内外多种信号通路的协调控制,确保胎脑结构及功能网络的有序发育。其中,IL-6细胞因子家族可以通过激活JAK/STAT3通路调控NPCs的自我更新和分化,在决定NPC细胞命运上有着至关重要的作用。罗敏华团队前期建立了最接近临床的先天性HCMV感染的NPCs细胞模型。基于该模型的研究发现HCMV感染NPCs过程中上调IL-6/JAK/STAT3信号通路的负调控蛋白SOCS3的表达。通过病毒蛋白筛选发现pUL97是引起SOCS3表达上调的病毒因子。对pUL97相互作用宿主蛋白的蛋白质组学分析鉴定了参与调控SOCS3表达的宿主转录因子regulatory factor X 7 ( RFX7 )。在NPCs中敲降UL97或RFX7表达均能阻断HCMV感染诱导的SOCS3上调。通过启动子-荧光素酶活性试验,发现pUL97的激酶活性和RFX7为SOCS3上调所必须,且在NPCs中表达UL97或感染HCMV,RFX7的磷酸化水平都会增加,表明pUL97诱导RFX7磷酸化以驱动SOCS3转录激活。进一步探索了SOCS3异常表达对神经发育的影响。在NPCs中持续过表达SOCS3可影响干细胞多能性,并抑制NPCs增殖和迁移;在小鼠胎脑发育过程中,SOCS3的过表达则导致NPCs成熟及迁移缺陷,影响胎脑发育。该研究揭示了HCMV感染引起神经发育异常的一种新调控机制:HCMV感染诱导的SOCS3可抑制正常水平的IL-6细胞因子家族介导的信号通路,导致NPCs增殖和迁移缺陷,从而影响胎脑发育,为进一步探讨先天性HCMV感染致胎脑畸形机制提供系新思路。武汉病毒所博士生王冼章,武汉病毒所-广州市妇女儿童医疗中心联合博士后温乐为共同第一作者;武汉病毒所罗敏华研究员,姜旋博士,上海市公共卫生临床中心程汉副研究员为共同通讯作者。该研究得到了国家自然科学基金的资助。
论文链接: https://doi.org/10.1371/journal.ppat.1011166
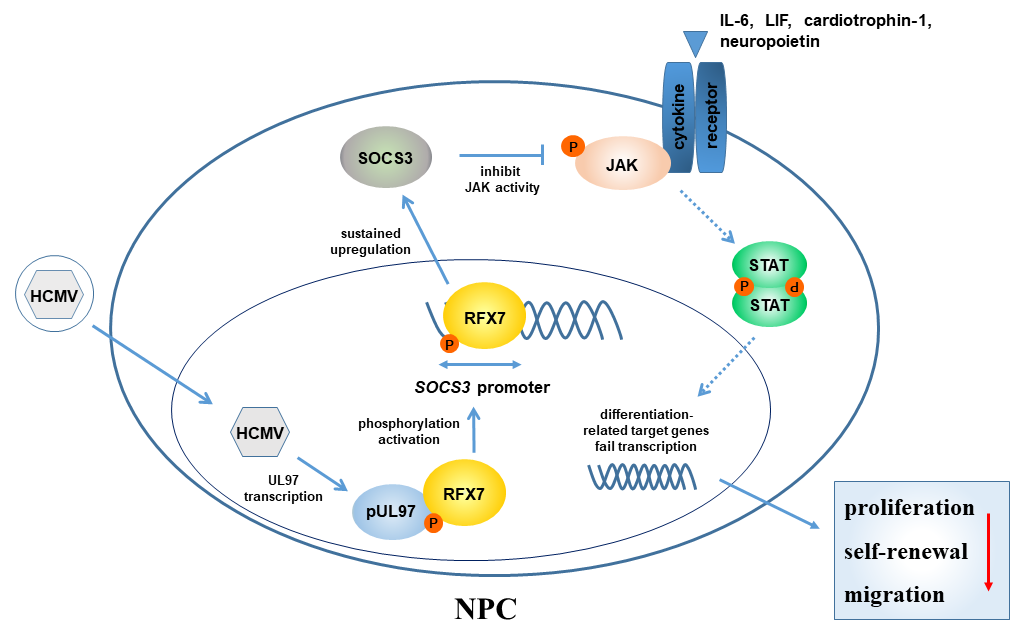
图示:HCMV感染NPCs上调SOCS3分子机制模式图

 科技服务
科技服务