科研进展
近日,中国科学院武汉病毒研究所/生物安全大科学研究中心曹晟研究员和胡志红研究员课题组合作在国际学术期刊《Journal of Virology》在线发表了题为 “口服感染因子PIF5的结构特征揭示杆状病毒口服感染过程中分子内相互作用的重要作用” (Structural Characterization of Per Os Infectivity Factor 5 (PIF5) Reveals the Essential Role of Intramolecular Interactions in Baculoviral Oral Infectivity)的研究论文。
杆状病毒在昆虫中的初始感染是由一系列被称作口服感染因子(Per Os Infectivity Factors, PIFs)的蛋白分子参与完成的。杆状病毒的代表种AcMNPV具有10个PIFs,除PIF5外,其他PIFs会形成复杂的复合物,缺失PIF5的病毒会完全丧失对昆虫的口服感染能力。该研究通过晶体学手段解析得到PIF5胞外域(PIF5 ectodomain, PIF5e)分辨率达2.2埃的晶体结构,截至目前,这是首个报道的杆状病毒口服感染因子结构。
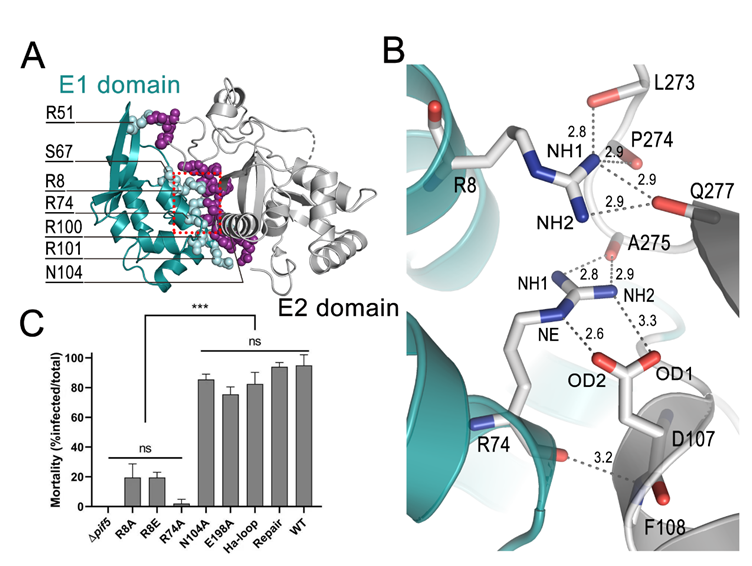
图1 (A)PIF5中E1和E2结构域以及两结构域间紧密的相互作用;(B)位于口袋底部的R8和R74两个残基参与构筑的氢键网络;(C)不同位点的突变对病毒口服感染能力的影响。
依据三级结构特征,PIF5e可被分为位于N端的E1与C端的E2结构域,两结构域之间通过氢键与盐桥紧密联系,在作用界面上形成一个开放式的口袋,口袋底部两个残基R8和R74与E2结构域构建了复杂的氢键网络。研究人员构建了一系列可能影响分子结构的突变体, 发现R8和R74位点突变的病毒口服感染能力明显下降。进一步的生化实验证实,R8和R74位点突变的PIF5会在碱性环境中被蛋白酶所降解,从而丧失口服感染能力,表明分子内相互作用在PIF5抵抗中肠碱性环境下的蛋白酶解过程中发挥重要作用。
武汉病毒所曹晟研究员,胡志红研究员为论文的通讯作者。博士生李志强、博士后张环宇、博士生李卓睿为文章的共同第一作者。该研究得到了中科院前沿科学重点研究项目(QYZDJ-SSW-SMC021)的经费支持。

 新闻
新闻